Το Εργαστήριο Κυτταρικής Ανοσολογίας ιδρύθηκε το 1989 και διεξάγει έρευνα εκεί όπου συναντώνται η ανοσολογία και η μικροβιολογία πρωτoζώων και βακτηρίων. Οι προκλινικές μελέτες μας βασίζονται σε πειραματικά μοντέλα ποντικών για μολυσματικές ασθένειες στις οποίες μελετάμε πτυχές της επαγόμενης έμφυτης και προσαρμοστικής ανοσίας μετά την ολοκλήρωση προφυλακτικών ή θεραπευτικών πρωτοκόλλων καινοτόμων εμβολίων ή νέων φαρμάκων. Επιδιώκουμε μια ολοκληρωμένη προσέγγιση δημιουργίας ενός ανοσολογικού προφίλ ικανού να προσδιορίσει αν οποιαδήποτε ανοσολογική παρέμβαση σε πειραματικά πρωτόκολλα μόλυνσης, θα μπορούσε να αναγνωριστεί ως επαγωγέας ενός προστατευτικού ή/και θεραπευτικού μηχανισμού που συσχετίζεται με τη βελτίωση της νόσου. Αυτή η συσχέτιση θα αποκαλύψει κυτταρικούς και μοριακούς στόχους για τον περαιτέρω σχεδιασμό επιτυχημένων ανοσολογικών παρεμβάσεων. Ειδικότερα οι ερευνητικές μας δραστηριότητες αφορούν:
• στην ανάπτυξη ανοσοθεραπευτικών παρεμβάσεων κατά των παθογόνων πρωτοζώων και βακτηρίων που βασίζονται σε συνθετικά προφυλακτικά ή/και θεραπευτικά εμβόλια
• στη διερεύνηση φυσικών προϊόντων ως πιθανών αντι-πρωτοζωικών φαρμάκων.
Για την επίτευξη της ερευνητικής δραστηριότητας που αφορά στην ανάπτυξη ανοσοθεραπευτικών παρεμβάσεων, ακολουθούμε την αντίστροφη μηχανική ανάπτυξης εμβολίων (reverse vaccinology), ως τομέα της εμβολιωμικής (vaccinomics), χρησιμοποιώντας βιολογικά δεδομένα και υπολογιστική ανάλυση, επιτυγχάνοντας ταχύτερο σχεδιασμό υποψήφιων εμβολίων σε σύγκριση με τη συμβατική εμβολιολογία. Η μέθοδος αυτή βασίζεται στη γονιδιωματική και επιτρέπει τον εντοπισμό ανοσοκυρίαρχων επιτόπων Τ και Β κυττάρων μεμβρανικών ή κυτταροπλαστικών πρωτεϊνών.
Παράλληλα αναζητώντας χημικές ενώσεις που φέρουν ταυτόχρονα αντι-παρασιτικές και ανοσοτροποποιητικές ιδιότητες, έχουμε αναπτύξει και χρησιμοποιούμε in vitro και in vivo αντι-παρασιτικές δοκιμασίες διαλογής φυσικών προϊόντων διερευνώντας τους μηχανισμούς δράσης αυτών.
Oι ερευνητικές μας δραστηριότητες επικεντρώνονται στα εξής πεδία μελέτης:
Α. Καινοτόμες ανοσοθεραπευτικές παρεμβάσεις σε μοντέλα λοιμωδών νοσημάτων.
Με τον όρο «ανοσοθεραπευτικές παρεμβάσεις» αναφερόμαστε σε θεραπευτικές δράσεις που τροποποιούν το ανοσολογικό σύστημα κατά τέτοιο τρόπο ώστε, όταν είναι επιτυχείς, να θεραπεύουν νοσήματα που ελέγχονται με ανοσολογικούς μηχανισμούς. Ειδικότερα, ασχολούμαστε με σύντομες παρεμβάσεις (εμβόλια) που προκαλούν σταθερό επαναπρογραμματισμό του ανοσολογικού συστήματος με αποτέλεσμα να είναι ικανό να παράγει αποτελεσματικούς προστατευτικούς ή/και θεραπευτικούς μηχανισμούς για έναν παθογόνο οργανισμό. Επιλέξαμε να ασχοληθούμε κυρίως με το υποχρεωτικά ενδοκυτταρικό πρωτόζωο Leishmania spp. που αποτελεί μικροοργανισμό ιδιαίτερης σημασίας για την Δημόσια Υγεία, τόσο στη χώρα μας όσο και παγκοσμίως [1], ενώ το πειραματικό του μοντέλο επιτρέπει την λεπτομερή διερεύνηση της διαφοροποίησης, λειτουργικότητας και «συνομιλίας» μεταξύ έμφυτης και επίκτητης ανοσίας [2,3].
Τουλάχιστον 20 διαφορετικά είδη του παρασίτου Leishmania spp. είναι μολυσματικά για τον άνθρωπο προκαλώντας μια σειρά ασθενειών γνωστές παγκοσμίως ως λεϊσμανιάσεις. Οι ασθένειες αυτές είναι ενδημικές σε 98 χώρες, εξαπλώνονται γεωγραφικά σε τροπικές και υποτροπικές περιοχές και μια τρέχουσα εκτίμηση αναφέρει ετήσια παγκόσμια επίπτωση 0,2-0,4 εκατομμυρίων κρουσμάτων σπλαγχνικής λεϊσμανίασης (Visceral Leishmaniasis, VL) και 0,7-1,2 εκατομμυρίων περιπτώσεων δερματικής λεϊσμανίασης (Cutaneous Leishmaniasis, CL). Η νόσος πλήττει σήμερα 12 εκατομμύρια άτομα και 350 εκατομμύρια άτομα κινδυνεύουν από αυτή [1]. Για την ανάπτυξη εμβολίων έναντι των λεϊσμανιάσεων σε πειραματικά μοντέλα πειραματοζώων, κυρίως ποντικών, έχουμε χρησιμοποιήσει ποικίλες προσεγγίσεις, όπως φυσικά αντιγόνα σε συνδυασμό με ισχυρά ανοσοενισχυτικά [4], κυτταρικούς εμβολιασμούς [5], ανασυνδυασμένες πρωτεΐνες, πολυπεπτίδια και πεπτίδια. Για την ανάπτυξη πειραματικών εμβολίων έχουμε εφαρμόσει in silico και in vitro προσεγγίσεις για τη χαρτογράφηση πιθανών επιτόπων, οι οποίοι στη συνέχεια δοκιμάζονται για την ανοσογονική τους ικανότητα χρησιμοποιώντας ex νίνο και in νίνο πειραματικά μοντέλα.
Τα μακροφάγα, ως υποχρεωτικά κύτταρα ξενιστές για τα παράσιτα του γένους Leishmania spp., διαδραματίζουν κεντρικό ρόλο στην αλληλεπίδραση μεταξύ έμφυτης και προσαρμοστικής ανοσίας με τα Τ κύτταρα που αναγνωρίζουν τα αντιγόνα του πρωτοζώου Leishmania spp., να παίζουν πρωταγωνιστικό ρόλο [6, 7, 8]. Για το σκοπό αυτό, οι μελέτες μας απευθύνονται άμεσα στα τρία σήματα που απαιτούνται για την επαγωγή ενεργοποίησης και διαφοροποίησης των Τ κυττάρων: την παρουσίαση αντιγόνου (Σήμα 1), την έκφραση των συν-διεγερτικών μορίων (Σήμα 2) και την παραγωγή κυτταροκινών (Σήμα 3). Η μελέτη αυτών των μονοπατιών επιτρέπει τη διερεύνηση δύο καίριων ζητημάτων στην προσπάθεια καταπολέμησης των λεϊσμανιάσεων: (α) ταυτοποίηση υποψήφιων αντιγόνων για την ανάπτυξη εμβολίων ικανών να προκαλέσουν μακροπρόθεσμη προφύλαξη και (β) προσδιορισμός του τρόπου δράσης φυσικών προϊόντων ως αντι-παρασιτικών, ανοσοτροποποιητικών και αντιφλεγμονωδών ενώσεων.
Σε in νίνο συνθήκη, τα κυτταρικά συστατικά της αντι-λεϊσμανιακής ανοσοαπόκρισης χαρακτηρίζονται από διήθηση μονοκυττάρων στη θέση μόλυνσης τα οποία διαφοροποιούνται σε δενδριτικά κύτταρα (DCs). Ορισμένα DCs γίνονται ξενιστές του παρασίτου χωρίς να ενεργοποιούνται, ενώ τα μη μολυσμένα DCs αυξάνουν την έκφραση των αντιγόνων MHC II. Αυτά τα DCs συσχετίζονται με παρασιτικά αντιγόνα και έτσι μετατρέπονται σε επαγγελματικά αντιγονοπαρουσιαστικά κύτταρα ικανά να επάγουν CD4+ TH1 κύτταρα που παράγουν IFN-y, IL-12 και TNF-α [3]. Συγχρόνως ενεργοποιούνται και CD8+ Τ κύτταρα που αναγνωρίζουν αντιγόνα του παρασίτου και παράγουν IFN-γ. Κάτω από αυτές τις συνθήκες, η INF-γ ενεργοποιεί τα κύτταρα-ξενιστές (μακροφάγα) για να καταστρέψουν τα ενδοκυτταρικά παράσιτα και τελικά να οδηγήσουν στην εξάλειψη της παρασιτικής μόλυνσης.
Α.1 Συνθετικά εμβόλια σε πειραματικά μοντέλα λεϊσμανιάσεων
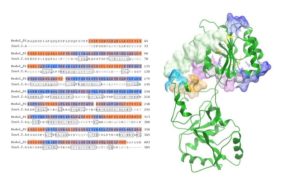 Πρόσφατα, η μελέτη μας εστιάστηκε σε μια κυτταροπλασματική πρωτεΐνη του πρωτοζώου Leishmania, ομόλογη με τον ευκαρυωτικό παράγοντα έναρξης eIF4A, η οποία κατέχει τόσο ιδιότητες αντιγόνου όσο και ανοσοενισχυτικού. Ο ευκαρυωτικός παράγοντας έναρξης του παρασίτου των Leishmania spp. (Leishmania eukaryotic initiation factor, LeIF) περιγράφηκε αρχικά ως φυσικό ανοσοενισχυτικό τύπου Th1 [9]. Συνεπώς, δοκιμάσαμε in vitro και in vivo την πιθανή του δράση ως υποψήφιο προστατευτικό ή/και ανοσοθεραπευτικό μόριο. H επίδραση της LeIF μελετήθηκε σε in vitro σύστημα μολυσμένων μακροφάγων, πριν ή μετά την έναρξη της μόλυνσης, για την δυνητικά προφυλακτική ή/και ανοσοθεραπευτική της δράση έναντι παρασίτων του στελέχους L. donovani. Η LeIF παρουσίασε ισχυρή αντι-λεϊσμανιακή δράση διαμεσολαβούμενη από την παραγωγή των αντιμικροβιακών μορίων ΝΟ και ROS καθώς και της κυτταροκίνης της προστατευτικής Th1 απόκρισης IL-12 με ταυτόχρονη ήπια παραγωγή της IL -10. Επιπλέον, η προστατευτική επίδραση της LeIF συσχετίστηκε με την ενεργοποίηση μίας οδού εξαρτώμενης από τον ΤΝF-α ενώ η ανοσοθεραπευτική της δραστικότητα (επίδραση της LeIF μετά την εγκατάσταση της μόλυνσης) συσχετίστηκε με την ενεργοποίηση ενός μονοπατιού ανεξάρτητου του ΤΝF-α [10]. Επιπλέον, με την αξιοποίηση των εργαλείων ανοσοπληροφορικής, χρησιμοποιήσαμε διαθέσιμους αλγόριθμους για την ανίχνευση ειδικών Τ επιτόπων έναντι του παρασίτου. Πέντε πεπτίδια (μήκους 16-18 αμινοξέων) που ανήκαν στο αμινο-τελικό τμήμα της LieIF και περιείχαν υποσχόμενους MHC τάξης Ι και ΙΙ επίτοπους, επιλέχθηκαν και αξιολογήθηκαν για τις ανοσογονικές και ανοσορυθμιστικές τους ιδιότητες. H αξιολόγησή τους σε ένα ex νίνο σύστημα ΒΜ-DCs αποκάλυψαν ότι το πεπτίδιο 52-68 aa (LieIF_2) εμφάνισε τις πιο ισχυρές ανοσορυθμιστικές ιδιότητες καθώς προκάλεσε αύξηση της έκφρασης των συν-διεγερτικών επιφανειακών μορίων CD80 και CD86, και την παραγωγή των προφλεγμονωδών κυτταροκινών ΤΝF-α και ΙΝF-γ [11]. Επιπλέον, η ανασυνδυασμένη πρωτεΐνη LieIF και επιλεγμένα ανασυνδυασμένα και αλληλεπικαλυπτόμενα πολυπεπτίδια της, βρέθηκε ότι επάγουν φαινοτυπική ωρίμανση και λειτουργική διαφοροποίηση των DCs που προέρχονται από μυελό οστών ποντικών (BM-DCs) και ήταν ικανά να προκαλέσουν προστασία σε πειραματικό μοντέλο δερματικής λεϊσμανίασης ποντικού. Τα δεδομένα αυτά υποδεικνύουν ότι επιλεγμένα τμήματα της ανασυνδυασμένης LieIF θα μπορούσαν να αξιοποιηθούν για την ανάπτυξη καινοτόμων προφυλακτικών συνθετικών εμβολίων ικανών να επάγουν αποτελεσματική ανοσία διαμεσολαβούμενη από MHC ΙΙ και MHC Ι περιορισμένες αποκρίσεις Τ-κυττάρων.
Πρόσφατα, η μελέτη μας εστιάστηκε σε μια κυτταροπλασματική πρωτεΐνη του πρωτοζώου Leishmania, ομόλογη με τον ευκαρυωτικό παράγοντα έναρξης eIF4A, η οποία κατέχει τόσο ιδιότητες αντιγόνου όσο και ανοσοενισχυτικού. Ο ευκαρυωτικός παράγοντας έναρξης του παρασίτου των Leishmania spp. (Leishmania eukaryotic initiation factor, LeIF) περιγράφηκε αρχικά ως φυσικό ανοσοενισχυτικό τύπου Th1 [9]. Συνεπώς, δοκιμάσαμε in vitro και in vivo την πιθανή του δράση ως υποψήφιο προστατευτικό ή/και ανοσοθεραπευτικό μόριο. H επίδραση της LeIF μελετήθηκε σε in vitro σύστημα μολυσμένων μακροφάγων, πριν ή μετά την έναρξη της μόλυνσης, για την δυνητικά προφυλακτική ή/και ανοσοθεραπευτική της δράση έναντι παρασίτων του στελέχους L. donovani. Η LeIF παρουσίασε ισχυρή αντι-λεϊσμανιακή δράση διαμεσολαβούμενη από την παραγωγή των αντιμικροβιακών μορίων ΝΟ και ROS καθώς και της κυτταροκίνης της προστατευτικής Th1 απόκρισης IL-12 με ταυτόχρονη ήπια παραγωγή της IL -10. Επιπλέον, η προστατευτική επίδραση της LeIF συσχετίστηκε με την ενεργοποίηση μίας οδού εξαρτώμενης από τον ΤΝF-α ενώ η ανοσοθεραπευτική της δραστικότητα (επίδραση της LeIF μετά την εγκατάσταση της μόλυνσης) συσχετίστηκε με την ενεργοποίηση ενός μονοπατιού ανεξάρτητου του ΤΝF-α [10]. Επιπλέον, με την αξιοποίηση των εργαλείων ανοσοπληροφορικής, χρησιμοποιήσαμε διαθέσιμους αλγόριθμους για την ανίχνευση ειδικών Τ επιτόπων έναντι του παρασίτου. Πέντε πεπτίδια (μήκους 16-18 αμινοξέων) που ανήκαν στο αμινο-τελικό τμήμα της LieIF και περιείχαν υποσχόμενους MHC τάξης Ι και ΙΙ επίτοπους, επιλέχθηκαν και αξιολογήθηκαν για τις ανοσογονικές και ανοσορυθμιστικές τους ιδιότητες. H αξιολόγησή τους σε ένα ex νίνο σύστημα ΒΜ-DCs αποκάλυψαν ότι το πεπτίδιο 52-68 aa (LieIF_2) εμφάνισε τις πιο ισχυρές ανοσορυθμιστικές ιδιότητες καθώς προκάλεσε αύξηση της έκφρασης των συν-διεγερτικών επιφανειακών μορίων CD80 και CD86, και την παραγωγή των προφλεγμονωδών κυτταροκινών ΤΝF-α και ΙΝF-γ [11]. Επιπλέον, η ανασυνδυασμένη πρωτεΐνη LieIF και επιλεγμένα ανασυνδυασμένα και αλληλεπικαλυπτόμενα πολυπεπτίδια της, βρέθηκε ότι επάγουν φαινοτυπική ωρίμανση και λειτουργική διαφοροποίηση των DCs που προέρχονται από μυελό οστών ποντικών (BM-DCs) και ήταν ικανά να προκαλέσουν προστασία σε πειραματικό μοντέλο δερματικής λεϊσμανίασης ποντικού. Τα δεδομένα αυτά υποδεικνύουν ότι επιλεγμένα τμήματα της ανασυνδυασμένης LieIF θα μπορούσαν να αξιοποιηθούν για την ανάπτυξη καινοτόμων προφυλακτικών συνθετικών εμβολίων ικανών να επάγουν αποτελεσματική ανοσία διαμεσολαβούμενη από MHC ΙΙ και MHC Ι περιορισμένες αποκρίσεις Τ-κυττάρων.
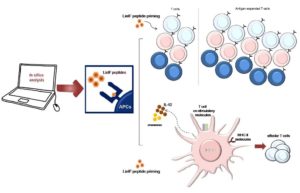
Περαιτέρω μελέτες που αφορούν στις ενδογενείς ανοσοενισχυτικές ιδιότητες της LieIF, θα συμβάλλουν στην ανάπτυξη συνθετικών εμβολίων. Τα εμβόλια πεπτιδίων είναι μια πολύ ελκυστική στρατηγική για τον εντοπισμό νέων αντιγόνων αλλά ελάχιστοι πεπτιδικοί επίτοποι είναι τόσο ανοσογονικοί ώστε να προκαλέσουν αποτελεσματικές αποκρίσεις ειδικών Τ-κυττάρων ικανών για την εξάλειψη του ενδοκυτταρικού παρασίτου [12, 13]. Ο συνδυασμός όμως αυτών με κατάλληλες ανοσοενισχυτικές συνθέσεις αποτελεί μια πολλά υποσχόμενη στρατηγική για την ανάπτυξη προφυλακτικών ή ακόμη και θεραπευτικών εμβολίων [14].
Α.2 Ανάπτυξη συνθετικού εμβολίου κατά του βακτηρίου Streptococcus pneumoniae.
Το βακτήριο Streptococcus pneumoniae (πνευμονιόκοκκος) είναι ένα Gram-θετικό α-αιμολυτικό βακτήριο που σχετίζεται κυρίως με την πνευμονία και τη μηνιγγίτιδα και αποτελεί παθογόνο υψηλής επιδημιολογικής σημασίας σε παγκόσμια κλίμακα. Είναι υπεύθυνο για περίπου 14,5 εκατομμύρια κρούσματα επιθετικής νόσου και περίπου 800.000 θανάτους παιδιών κάτω των 5 ετών, ετησίως. Σήμερα χρησιμοποιούνται δύο είδη εμβολίων κατά της πνευμονιοκοκκικής νόσου, το πολυσακχαριδικό και το συζευγμένο εμβόλιο [15, 16]. Η μελέτη μας εστιάστηκε σε τέσσερις ανοσοκυρίαρχους επίτοπους των Β κυττάρων που εντοπίζονται στις πνευμονιοκοκκικές επιφανειακές πρωτεΐνες (Virulence Pneumococcal Surface Proteins, VPPS) CbpD, PhtD, PhtE και ZmpB [17]. Σε πειραματικό μοντέλο πνευμονίας, ποντικοί που ανοσοποιήθηκαν ενεργά με καθένα από τα επιλεγμένα ανάλογα των προαναφερθέντων επιτόπων ή με ένα μίγμα αυτών (ομάδα Mix), έδειξαν αυξημένη επιβίωση έναντι θανατηφόρου δόσης του εξαιρετικά λοιμογόνου πνευμονιοκοκκικού ορότυπου 3 (Serotype 3). Επίσης, η παθητική μεταφορά υπεράνοσου ορού από την ομάδα των ποντικών που ανοσοποιήθηκαν με το μίγμα των πεπτιδίων, σε φυσιολογικά ποντίκια, οδήγησε σε ιδιαίτερα αυξημένη επιβίωση των ζώων μετά από τη χορήγηση θανατηφόρου δόσης με τον ορότυπο 3, γεγονός που καταδεικνύει την ανάπτυξη μηχανισμού(-ών) προστασίας που μεσολαβείται από ειδικά αντισώματα. Είναι επιπλέον αξιοσημείωτο ότι τα πεπτίδια PhD_pep19 και PhtE_pep40, τα οποία βρίσκονται εντός των περιοχών δέσμευσης ψευδαργύρου των πρωτεϊνών PhtD και PhtE εμφάνισαν ισχυρότερα ανοσολογικά χαρακτηριστικά [18]. Δεδομένου ότι η πρόσληψη ψευδαργύρου έχει μεγάλη σημασία για τη λοιμογόνο δράση του πνευμονιόκοκκου, αυτές οι μελέτες υποδεικνύουν ότι αυτοί οι επίτοποι αξίζουν περαιτέρω έρευνα ως νέες συνθετικές ενώσεις για την ανάπτυξη ενός πνευμονιοκοκκικού εμβολίου ανεξάρτητου από πολυσακχαρίτες.
B. Προστατευτική και θεραπευτική δράση φυσικών προϊόντων
Οι περιορισμένες επιλογές φαρμάκων και η πιθανότητα ανάπτυξης ανθεκτικότητας είναι σημαντικό και σοβαρό εμπόδιο στην εξάλειψη της λεϊσμανίασης παγκοσμίως. Η ανάπτυξη νέων αποτελεσματικών, ασφαλών και οικονομικά προσιτών φαρμάκων κατά της λεϊσμανίασης είναι επιτακτικής σημασίας. Τα περισσότερα χημικά φάρμακα που χρησιμοποιούνται ευρέως σήμερα απομονώθηκαν από φυσικά προϊόντα και για αυτό εξακολουθούν να αποτελούν σημαντικές πρώτες ύλες για την ανάπτυξη νέων φαρμάκων [19]. Τα φυσικά φαρμακευτικά προϊόντα που προέρχονται από την ελιά (Olea europaea) είναι μεγάλης σημασίας δεδομένου ότι αναγνωρίζεται ευρέως ότι ο πληθυσμός που κατοικεί στην περιοχή της Μεσογείου παρουσιάζει χαμηλή συχνότητα εμφάνισης χρόνιων φλεγμονωδών ασθενειών και υψηλότερο προσδόκιμο επιβίωσης σε σύγκριση με πληθυσμούς άλλων γεωγραφικών περιοχών. Ένα σημαντικό συστατικό της μεσογειακής διατροφής είναι η καθημερινή κατανάλωση του εξαιρετικού παρθένου ελαιολάδου (Extra Virgin Olive Oil, EVOO), το οποίο έχει διερευνηθεί διεξοδικά για τα ευεργετικά αποτελέσματα στην ανθρώπινη υγεία. Πράγματι, παρόλο που υπάρχει ένα μάλλον μικρό φαινολικό κλάσμα στο EVOO, εμφανίζει ένα ευρύ φάσμα βιολογικών δραστικοτήτων in vitro και in vivo όπως αντιφλεγμονώδες, αντιμικροβιακό και αντιοξειδωτικό [20]. Η δράση τους ως αντιμικροβιακές, αντιοξειδωτικές και αντιφλεγμονώδεις ουσίες φαίνεται να προκαλείται από τη μείωση των αντιδρώντων ελεύθερων ριζών οξυγόνου (ROS) ενώ ταυτόχρονα ρυθμίζουν φλεγμονώδεις μεσολαβητές όπως για παράδειγμα την επαγώγιμη συνθετάση νιτρικού οξειδίου (iNOS) η οποία είναι ένας κρίσιμος παράγοντας στην ανάπτυξη χρόνιων φλεγμονωδών ασθενειών. Το ερευνητικό μας ενδιαφέρον επικεντρώνεται στην ισχυρή φαρμακολογική δράση των φαινολικών ενώσεων της ελιάς κατά των λοιμώξεων από πρωτόζωα και πιο συγκεκριμένα, εξετάσαμε την επίδρασή τους σε in vitro και in vivo πειραματικά μοντέλα μολύνσεων από Leishmania spp. Έμφαση δίνεται στην αναζήτηση φαινολικών ενώσεων με διπλή επίδραση τόσο έναντι του παθογόνου, όσο και στο ανοσοποιητικό σύστημα του ξενιστή, προκειμένου να διαλευκανθεί ο τρόπος δράσης τους ως νέων ενώσεων ή φαρμάκων [21].
Β.1 Αξιολόγηση των ενώσεων που προέρχονται από τα φύλλα της ελιάς και τα λύματα του ελαιοτριβείου για αντιλεϊσμανιακή δράση.
 Η επιστημονική μας προσέγγιση αφορά στη διερεύνηση της αντιλεϊσμανιακής δραστικότητας διαφόρων ενώσεων που υπάρχουν στα φύλλα της ελιάς και στα απόβλητα των ελαιοτριβείων της Olea europaea L. (Oleaceae) ενάντι των προμαστιγωτών και αμαστιγωτών μορφών του παρασίτου Leishmania spp. Η πλειονότητα αυτών των ενώσεων επέδειξε αντιλεϊσμανιακή δράση ενώ η ελαιοευρωπεΐνη (Oleuropein) άσκησε το καλύτερο ανασταλτικό αποτέλεσμα σε προμαστιγώτες των στελεχών L. infantum, L. donovani και L. major στατικής καθώς και μέσης λογαριθμικής φάσης ανάπτυξης. Επιπλέον, μελετήθηκε η επίδραση της ελαιοευρωπεΐνης σε πειραματικό μοντέλο σπλαγχνικής λεϊσμανίασης και βρέθηκε ότι όταν BALB/c ποντίκια υποβλήθηκαν σε αγωγή με ελαιοευρωπεΐνη μετά από πειραματική μόλυνση με το στέλεχος L donovani παρατηρήθηκε σταθερή παρεμπόδιση της εξάπλωσης των παρασίτων στον σπλήνα και ήπαρ [22]. Βρέθηκε επίσης ότι η ελαιοευρωπεΐνη μπορεί να οδηγήσει το παράσιτο σε αποπτωτικό κυτταρικό θάνατο ο οποίος συγκρατεί τις φλεγμονώδεις διεργασίες που διευκολύνουν την παρασιτική εξάπλωση στους ιστούς. Ο παρασιτικός κυτταρικός θάνατος, αν και δεν διαθέτει τυπικούς μεταβολικούς μοριακούς ρυθμιστές απόπτωσης, περιλαμβάνει την παραγωγή ενδοκυτταρικών ROS, την ομοιόσταση Ca+2 και ΔΨm των μιτοχονδρίων, που παίζουν κεντρικό ρόλο σε αυτή τη βιολογική διαδικασία. Έτσι, η απουσία φλεγμονωδών ερεθισμάτων θα επιτρέψει στους ξενιστές να παράγουν δυναμικές ανοσολογικές αποκρίσεις ικανές να ελαχιστοποιήσουν την εξάπλωση των παρασίτων [23].
Η επιστημονική μας προσέγγιση αφορά στη διερεύνηση της αντιλεϊσμανιακής δραστικότητας διαφόρων ενώσεων που υπάρχουν στα φύλλα της ελιάς και στα απόβλητα των ελαιοτριβείων της Olea europaea L. (Oleaceae) ενάντι των προμαστιγωτών και αμαστιγωτών μορφών του παρασίτου Leishmania spp. Η πλειονότητα αυτών των ενώσεων επέδειξε αντιλεϊσμανιακή δράση ενώ η ελαιοευρωπεΐνη (Oleuropein) άσκησε το καλύτερο ανασταλτικό αποτέλεσμα σε προμαστιγώτες των στελεχών L. infantum, L. donovani και L. major στατικής καθώς και μέσης λογαριθμικής φάσης ανάπτυξης. Επιπλέον, μελετήθηκε η επίδραση της ελαιοευρωπεΐνης σε πειραματικό μοντέλο σπλαγχνικής λεϊσμανίασης και βρέθηκε ότι όταν BALB/c ποντίκια υποβλήθηκαν σε αγωγή με ελαιοευρωπεΐνη μετά από πειραματική μόλυνση με το στέλεχος L donovani παρατηρήθηκε σταθερή παρεμπόδιση της εξάπλωσης των παρασίτων στον σπλήνα και ήπαρ [22]. Βρέθηκε επίσης ότι η ελαιοευρωπεΐνη μπορεί να οδηγήσει το παράσιτο σε αποπτωτικό κυτταρικό θάνατο ο οποίος συγκρατεί τις φλεγμονώδεις διεργασίες που διευκολύνουν την παρασιτική εξάπλωση στους ιστούς. Ο παρασιτικός κυτταρικός θάνατος, αν και δεν διαθέτει τυπικούς μεταβολικούς μοριακούς ρυθμιστές απόπτωσης, περιλαμβάνει την παραγωγή ενδοκυτταρικών ROS, την ομοιόσταση Ca+2 και ΔΨm των μιτοχονδρίων, που παίζουν κεντρικό ρόλο σε αυτή τη βιολογική διαδικασία. Έτσι, η απουσία φλεγμονωδών ερεθισμάτων θα επιτρέψει στους ξενιστές να παράγουν δυναμικές ανοσολογικές αποκρίσεις ικανές να ελαχιστοποιήσουν την εξάπλωση των παρασίτων [23].
Β.2 Αξιολόγηση της in νiνο αντι-λεϊσμανιακής δράσης της ελαιοευρωπεΐνης.
Τα ποντίκια που έλαβαν αγωγή με ελαιοευρωπεΐνη παρουσίασαν εκτεταμένο οξειδωτικό στρες, το οποίο παρεμποδίστηκε με την αυξητική ρύθμιση του αντιοξειδωτικού ενζύμου του ξενιστή (GCLC) και την ταυτόχρονη μείωση της ρύθμισης του αντίστοιχου ενζύμου του παρασίτου (LdGCLC), με αποτέλεσμα τα παράσιτα να είναι περισσότερο ευάλωτα για καταστροφή. Η ελαιοευρωπεΐνη συνέβαλε στην επαγωγή σημαντικής πολικότητας προς την Th1 τύπου ανοσολογική απάντηση που χαρακτηρίζεται από την έκφραση των γονιδίων των κυτταροκινών IL-12β, IL-10, ΤGF-β1, IFN-γ και των μεταγραφικών παραγόντων Tbx21 και GATA3 σε σπληνοκύτταρα. Αυτό το ανοσοτροποποιητικό αποτέλεσμα της ελαιοευρωπεΐνης συσχετίστηκε με ανασταλτική επίδραση στην έκφραση του γονιδίου IL-1β, και όχι στην έκφραση των IL-1a, IL-1rn και TNF-a γονιδίων. Επιπλέον, οι BALB/c ποντικοί που υποβλήθηκαν σε θεραπεία με ελαιοευρωπεΐνη διαμόρφωσαν μια ανοσολογική απόκριση υπερευαισθησίας καθυστερημένου τύπου (DTH) υποδεικνύοντας την επαγωγή ενός αποτελεσματικού κυτταρομεσολαβούμενου ανοσολογικού μηχανισμού ικανού να ελαχιστοποιήσει την εξάπλωση των παρασίτων σε μολυσμένα πειραματόζωα [24].
Τα υποσχόμενα νέα φάρμακα κατά των λεϊσμανιάσεων θα πρέπει να είναι σε θέση να καταστρέψουν το παράσιτο και ταυτόχρονα να ευνοήσουν τις επιθυμητές ανοσολογικές αντιδράσεις. Για το σκοπό αυτό διερευνήσαμε καθαρισμένα κλάσματα ακατέργαστων εκχυλισμάτων όπως το ολικό φαινολικό εκχύλισμα του εξαιρετικού παρθένου ελαιολάδου [25] ενώ τρέχουσες μελέτες αφορούν απομονωμένες ουσίες του, όπως για παράδειγμα την ελαιοκανθάλη, για την αντιπαρασιτική και ανοσοτροποποιητική τους ικανότητα να ευνοήσουν την επαγωγή μιας κατάλληλης Τh 1 τύπου ανοσοαπόκρισης. Αξίζει να σημειωθεί ότι η ελαιοκανθάλη (διαλδεϋδική μορφή του άγλυκου του δικαρβοξυμεθυλ- λιγστροσίδη) είναι ομόλογο με το μη στεροειδές αντιφλεγμονώδες φάρμακο (NSAID) ιβουπροφαίνη [26]. Στην περίπτωση της φυσικής λοίμωξης με το πρωτόζωο Leishmania, αυτή η χαρακτηριστική αντιφλεγμονώδης δραστικότητα συστατικών του ελαιολάδου είναι απαραίτητη για τη ρύθμιση της προφλεγμονώδους αντίδρασης που προκαλείται από την εισβολή του παρασίτου έτσι ώστε να παρεμποδίζεται η υπερβολική βλάβη των ιστών και τελικά να επιτυγχάνεται η επαγωγή μιας ανοσολογικής απόκρισης ικανής να συμβάλει στη βελτίωση του νοσήματος. Oι φαινόλες του εξαιρετικού παρθένου ελαιόλαδου, σαν βασικό στοιχείο της Μεσογειακής διατροφής μέσω της οποίας προσλαμβάνονται σε χαμηλές αλλά χρόνιες δόσεις σαν φυσικά NSAID, έχουν σημαντικό ενδιαφέρον τόσο στη διατήρηση της υγείας όσο και στις ασθένειες. Η μελέτη των μοριακών και ανοσολογικών μηχανισμών που ελέγχουν προ-φλεγμονώδεις αντιδράσεις θα οδηγήσει στην περαιτέρω ταυτοποίηση διατροφικών συστατικών με σαφή βιολογική δραστικότητα προς την μείωση της ανάπτυξης χρόνιων φλεγμονωδών νόσων.
Γ. Φυσικά προϊόντα ως κτηνοτροφικά λειτουργικά θρεπτικά συστατικά για την καταπολέμηση των παρασιτικών και ιογενών ασθενειών των ψαριών teleost σε εντατικές υδατοκαλλιέργειες.
Διάφορα φυσικά προϊόντα περιλαμβάνονται στην παρασκευή ζωοτροφών για τη βελτίωση της μετατρεψιμότητας των ζωοτροφών και/ή του ημερήσιου κέρδους βάρους σε ψάρια, για τη μείωση της θνησιμότητας με ρύθμιση της μικροχλωρίδας του εντέρου ή/και με την προστασία του ζώου από παθογόνους μικροοργανισμούς [27]. Η υδατοκαλλιέργεια αναπτύσσεται ταχύτερα από όλους τους άλλους τομείς παραγωγής τροφίμων και η Ελλάδα, παρά την οικονομική κρίση, παραμένει σημαντικός παγκόσμιος παραγωγός με ετήσια παραγωγή 110.000 τόνων ψαριών. Επομένως ένα σημαντικό πλεονέκτημα στη χρήση φυσικών προϊόντων στην διατροφή των ψαριών είναι ότι δεν αποτελούν απειλή για τα ψάρια, τον άνθρωπο ή το περιβάλλον λόγω της βιο-αποικοδόμησής τους. Διεξάγαμε μελέτες με τη χρήση φυσικών προϊόντων ως εναλλακτικών λύσεων σε εμβόλια, αντιβιοτικά ή χημειοθεραπευτικούς παράγοντες, έναντι παρασιτικής και ιϊκής μόλυνσης, σε συνεργασία με την Fish Feed Industries και άλλα ερευνητικά κέντρα και πανεπιστήμια [28].
Η τσιπούρα είναι ένα από τα δύο κύρια μεσογειακά είδη ψαριών στην υδατοκαλλιέργεια και παράγεται κυρίως σε θαλάσσιους κλωβούς. Η αυξανόμενη ποσότητα εκμεταλλεύσεων θαλάσσιων κλωβών αυξάνει τη συχνότητα και τη διασπορά των παρασιτικών ασθενειών. Οι κακές πρακτικές διαχείρισης και το περιβαλλοντικό stress επιδεινώνουν αυτό το φαινόμενο σε μονάδες εντατικής εκτροφής και περιορίζουν την επίτευξη ικανοποιητικής παραγωγής. Οι μελέτες μας εστιάστηκαν στις επιδράσεις του καπρυλικού οξέος στο ανοσοποιητικό σύστημα των ψαριών κατά τη διάρκεια φυσικής μόλυνσης με εκτοπαράσιτα σε μονάδα εντατικής εκτροφής [29]. Ελέγξαμε την γονιδιακή έκφραση των IL-1b, TNF-α, ηπατιδίνης, IgHM και GRP-75 στην κεφαλή του νεφρού από ψάρια που έχουν μολυνθεί με Cryptocaryon spp. και Trichodina spp. Τα μολυσμένα ψάρια που τράφηκαν με υψηλή δόση καπρυλικού οξέος εμφάνισαν σημαντικά αυξημένη γονιδιακή έκφραση του γονιδίου της ηπατιδίνης σε χαμηλές θερμοκρασίες, που δείχνουν ότι η σύνθεση της ηπατιδίνης αυξάνεται κατά τη διάρκεια της παρασιτικής μόλυνσης ως βασικός μεσολαβητής της αναιμίας και της υποξίας.
Συμπερασματικά, διαπιστώθηκε αλληλεξάρτηση μεταξύ του διαιτολογικού καπρυλικού οξέος, του ανοσοποιητικού συστήματος των ψαριών και της παρασιτικής μόλυνσης της τσιπούρας (Sparus aurata) σε κλωβούς εντατικής εκτροφής σε ανοικτή θάλασσα. Είναι σημαντική η περαιτέρω διερεύνηση της επίδρασης του καπρυλικού οξέος και άλλων φυσικών προϊόντων στην διατροφή περισσότερων ειδών εντατικά καλλιεργουμένων ψαριών. Επίσης, μελέτες για την επίδραση του ριγανέλαιου σε πειραματικές μολύνσεις με το ιό Νoda κατέδειξαν την θετική επίδραση του στην αντιμετώπιση της λοίμωξης μέσω την ενεργοποίησης μηχανισμών φυσικής και επίκτητης ανοσίας.
Σχετική Βιβλιογραφία:
1. WHO LEISHMANIASIS: The magnitude of the problem. 2014
Available at: http://www.who.int/leishmaniasis/burden/magnitude/burden_magnitude/en/
2. Kaye P, Scott P. Leishmaniasis: complexity at the host-pathogen interface. Nat Rev Microbiol. 2011 Jul 11;9(8):604-15. doi: 10.1038/nrmicro2608. Review. PubMed PMID: 21747391.
3. Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145-73. Review. PubMed PMID: 2523712.
4. Papadopoulou G, Karagouni E, Dotsika E. ISCOMs vaccine against experimental leishmaniasis. Vaccine. 1998 May-Jun;16(9-10):885-92. PubMed PMID: 9682333.
5. Tsagozis P, Karagouni E, Dotsika E. Dendritic cells pulsed with peptides of gp63 induce differential protection against experimental cutaneous leishmaniasis. Int J Immunopathol Pharmacol. 2004 Sep-Dec;17(3):343-52. PubMed PMID: 15461868.
6. Tseveleki V, Tsagozis P, Koutsoni O, Dotsika E, Probert L. Cellular FLIP long isoform transgenic mice overcome inherent Th2-biased immune responses to efficiently resolve Leishmania major infection. Int Immunol. 2007, 19(10):1183-9. Epub 2007 Sep 18. PubMed PMID: 17878261.
7. Tsagozis P, Karagouni E, Dotsika E. Function of CD8+ T lymphocytes in a self-curing mouse model of visceral leishmaniasis. Parasitol Int. 2005 Jun;54(2):139-46. PubMed PMID: 15866476.
8. Tsagozis P, Karagouni E, Dotsika E. CD8(+) T cells with parasite-specific cytotoxic activity and a Tc1 profile of cytokine and chemokine secretion develop in experimental visceral leishmaniasis. Parasite Immunol. 2003. Nov-Dec;25(11-12):569-79. PubMed PMID: 15053778.
9. Skeiky, Y.A., et al., A recombinant Leishmania antigen that stimulates human peripheral blood mononuclear cells to express a Th1-type cytokine profile and to produce interleukin 12. J Exp Med, 1995. 181(4): p. 1527-37.
10. Koutsoni O, Barhoumi M, Guizani I, Dotsika E. Leishmania eukaryotic initiation factor (LeIF) inhibits parasite growth in murine macrophages. PLoS One. 2014 May 15;9(5):e97319. doi: 10.1371/journal.pone.0097319. eCollection 2014. PubMed PMID: 24830439; PubMed Central PMCID: PMC4022710.
11. Koutsoni OS, Routsias JG, Kyriazis ID, Barhoumi M, Guizani I, Tsakris A, Dotsika E. In silico analysis and in vitro evaluation of immunogenic and immunomodulatory properties of promiscuous peptides derived from Leishmania infantum eukaryotic initiation factor. Bioorg Med Chem. 2017 Nov 1;25(21):5904-5916. doi: 10.1016/j.bmc.2017.07.013. Epub 2017 Jul 8. PubMed PMID: 28974324.
12. Agallou M, Athanasiou E, Koutsoni O, Dotsika E, Karagouni E. Experimental Validation of Multi-Epitope Peptides Including Promising MHC Class I- and II-Restricted Epitopes of Four Known Leishmania infantum Proteins. Front Immunol. 2014 Jun 10;5:268. doi: 10.3389/fimmu.2014.00268. eCollection 2014. PubMed PMID: 24959167; PubMed Central PMCID: PMC4051127.
13. De Brito RCF, Cardoso JMO, Reis LES, Vieira JF, Mathias FAS, Roatt BM, Aguiar-Soares RDDO, Ruiz JC, Resende DM, Reis AB. Peptide Vaccines for Leishmaniasis. Front Immunol. 2018 May 11;9:1043. doi: 10.3389/fimmu.2018.01043. eCollection 2018. Review. PubMed PMID: 29868006; PubMed Central PMCID: PMC5958606.
14. Iborra S, Solana JC, Requena JM, Soto M. Vaccine candidates against leishmania under current research. Expert Rev Vaccines. 2018 Apr;17(4):323-334. doi: 10.1080/14760584.2018.1459191. Epub 2018 Apr 10. PubMed PMID: 29589966.
15. Principi N, Esposito S. Development of pneumococcal vaccines over the last 10 years. Expert Opin Biol Ther. 2018 Jan;18(1):7-17. doi: 10.1080/14712598.2018.1384462. Epub 2017 Oct 12. Review. PubMed PMID: 29022363.
16. Brooks WA, Chang LJ, Sheng X, Hopfer R; PPR02 Study Team. Safety and immunogenicity of a trivalent recombinant PcpA, PhtD, and PlyD1 pneumococcal protein vaccine in adults, toddlers, and infants: A phase I randomized controlled study. Vaccine. 2015 Aug 26;33(36):4610-7. doi: 10.1016/j.vaccine.2015.06.078. Epub 2015 Jul 2. PubMed PMID: 26143615.
17. Lagousi T, Routsias J, Piperi C, Tsakris A, Chrousos G, Theodoridou M, Spoulou V. Discovery of Immunodominant B Cell Epitopes within Surface Pneumococca. Virulence Proteins in Pediatric Patients with Invasive Pneumococcal Disease. J. Biol Chem. 2015 Nov 13;290(46):27500-10. doi: 10.1074/jbc.M115.666818. Epub 2015 Sep 22. PubMed PMID: 26396191; PubMed Central PMCID: PMC4646002.
18. Papastamatiou T, Routsias JG, Koutsoni O, Dotsika E, Tsakris A, Spoulou V. Evaluation of Protective Efficacy of Selected Immunodominant B-Cell Epitopes within Virulent Surface Proteins of Streptococcus pneumoniae. Infect Immun. 2018 Feb 20;86(3). pii: e00673-17. doi: 10.1128/IAI.00673-17. Print 2018 Mar. PubMed PMID: 29263108; PubMed Central PMCID: PMC5820952.
19. Andrade-Neto VV, Cunha-Junior EF, Dos Santos Faioes V, Pereira TM, Silva RL, Leon LL, Torres-Santos EC. Leishmaniasis treatment: update of possibilities for drug repurposing. Front Biosci (Landmark Ed). 2018 Jan 1;23:967-996. Review. PubMed PMID: 28930585.
20. Cicerale S, Lucas LJ, Keast RS. Antimicrobial, antioxidant and anti-inflammatory phenolic activities in extra virgin olive oil. Curr Opin Biotechnol. 2012 Apr;23(2):129-35. doi: 10.1016/j.copbio.2011.09.006. Epub 2011 Oct 13. Review. PubMed PMID: 22000808.
21. Rodrigues IA, Mazotto AM, Cardoso V, Alves RL, Amaral AC, Silva JR, Pinheiro AS, Vermelho AB. Natural Products: Insights into Leishmaniasis Inflammatory Response. Mediators Inflamm. 2015;2015:835910. doi: 10.1155/2015/835910. Epub 2015 Oct 11. Review. PubMed PMID: 26538837; PubMed Central PMCID: PMC4619978.
22. Kyriazis JD, Aligiannis N, Polychronopoulos P, Skaltsounis AL, Dotsika E. Leishmanicidal activity assessment of olive tree extracts. Phytomedicine. 2013 Feb 15;20(3-4):275-81. doi: 10.1016/j.phymed.2012.11.013. Epub 2012 Dec 27. PubMed PMID: 23273752.
23. Kyriazis ID, D Smirlis, A Papadaki, O Koutsoni, N Aligiannis, AL Skaltsounis and E. Dotsika. Leishmanicidal Activity of Oleuropein: Leishmania donovani Promastigote Cell Death through a Possibly ROS-Independent Mechanism J Pharmacogn Nat Prod 2017, 3:1 DOI: 10.4172/2472-0992.1000141
24. Kyriazis ID, Koutsoni OS, Aligiannis N, Karampetsou K, Skaltsounis AL, Dotsika E. The leishmanicidal activity of oleuropein is selectively regulated through inflammation- and oxidative stress-related genes. Parasit Vectors. 2016 Aug 9;9(1):441. doi: 10.1186/s13071-016-1701-4. PubMed PMID: 27501956; PubMed Central PMCID: PMC4977900.
25. Koutsoni O, K Karampetsou, ID Kyriazis, P Stathopoulos, N Aligiannis, M. Halabalaki, LA Skaltsounis, E Dotsika. Evaluation of total phenolic fraction derived from extra virgin olive oil for its antileishmanial activity. Phytomedicine 2018, DOI: 10.1016/j.phymed.2018.04.030 (in press)
26. Beauchamp GK, Keast RS, Morel D, Lin J, Pika J, Han Q, Lee CH, Smith AB, Breslin PA. Phytochemistry: ibuprofen-like activity in extra-virgin olive oil. Nature. 2005 Sep 1;437(7055):45-6. PubMed PMID: 16136122.
27. Zhu LY, Nie L, Zhu G, Xiang LX, Shao JZ. Advances in research of fish immune-relevant genes: a comparative overview of innate and adaptive immunity in teleosts. Dev Comp Immunol. 2013 Jan-Feb;39(1-2):39-62. doi:10.1016/j.dci.2012.04.001. Epub 2012 Apr 12. Review. PubMed PMID: 22504163.
28. Awad E, Awaad A. Role of medicinal plants on growth performance and immune status in fish. Fish Shellfish Immunol. 2017 Aug;67:40-54. doi:10.1016/j.fsi.2017.05.034. Epub 2017 May 16. Review. PubMed PMID: 28526570.
29. Rigos G, E. Fountoulaki, E. Cottou, E. Dotsika, N. Dourala, I. Karacostas (2013). “Tissue distribution and field evaluation of caprylic acid against natural infections of Sparicotyle chrysophrii in cage-reared gilthead sea bream Sparus aurata.” Aquaculture 408-409:15-19.
2018-2019, ΕΘΝΙΚΟ ΕΡΓΑΣΤΗΡΙΟ ΑΝΑΦΟΡΑΣ ΛΕΙΣΜΑΝΙΑΣΕΩΝ, ΚΕΕΛΠNΟ
«ΜΟΡΙΑΚΗ ΔΙΑΓΝΩΣΗ ΚΑΙ ΤΑΥΤΟΠΟΙΗΣΗ ΕΙΣΑΓΩΜΕΝΩΝ ΚΑΙ ΑΥΤΟΧΘΟΝΩΝ ΠΑΡΑΣΙΤΙΚΩΝ ΕΙΔΩΝ ΤΟΥ ΓΕΝΟΥΣ Leishmania ΑΠΟ ΚΛΙΝΙΚΑ ΠΕΡΙΣΤΑΤΙΚΑ ΛΕΙΣΜΑΝΙΑΣΕΩΝ»
2016-2017, AWARD TO YOUNG INVESTIGATOR from the European Society for Pedriatic Infectious Diseases.
«T-CELL MEMORY RESPONSE AGAINST IMMUNODOMINANT B-CELL EPITOPES OF PNEUMOCOCCAL VIRULENCE PRTEINS FOLLOWING IMMUNIZATION AND THEIR ROLE IN PROTECTION AGAINST S. pneumoniae PNEUMONIA IN MURINE MODEL»
2013-2015, Αναπτυξιακή Πρόταση Ερευνητικών Φορέων KΡΗΠΙΣ (MIS450598), Ευρωπαϊκή Ένωση και Υπουργείο Παιδείας και Θρησκευμάτων.
«ΛΟΙΜΩΔΗ ΚΑΙ ΝΕΥΡΟΕΚΦΥΛΙΣΤΙΚΑ ΝΟΣΗΜΑΤΑ ΣΤΟΝ 21ο ΑΙΩΝΑ: ΑΠΟ ΤΗΝ ΒΑΣΙΚΗ ΕΡΕΥΝΑ ΣΤΗΝ ΑΝΑΠΤΥΞΗ ΜΕΤΑΦΡΑΣΤΙΚΗΣ ΕΡΕΥΝΑΣ ΚΑΙ ΤΕΧΝΟΛΟΓΙΩΝ ΑΙΧΜΗΣ ΣΤΟΧΕΥΟΝΤΑΣ ΣΤΗΝ ΔΙΑΓΝΩΣΗ ΤΗΝ ΠΡΟΣΤΑΣΙΑ ΚΑΙ ΤΗΝ ΘΕΡΑΠΕΙΑ»
2012-2013, Transversal Research Programs within the RIIP (PTR No 426) «STRACTURAL AND EXPERIMENTAL APPROACHES TO VALIDATE Leishmania LeIF ANTIGEN AS DRUG TARGET AND IMMUNOTHERAPEUTIC MOLECULE»
2012-2015, ΘΑΛΗΣ (MIS 375267) ΕΥΡΩΠΑΙΚΗ ΕΝΩΣΗ & ΥΠΟΥΡΓΕΙΟ ΠΑΙΔΕΙΑΣ
«ΑΝΑΛΥΣΙΣ ΤΩΝ ΑΝΟΣΟΠΑΘΟΛΟΓΙΚΩΝ ΜΗΧΑΝΙΣΜΩΝ ΠΟΥ ΕΠΑΓΟΝΤΑΙ ΣΤΗ ΦΥΣΙΚΗ Η/ΚΑΙ ΠΕΙΡΑΜΑΤΙΚΗ ΜΟΛΥΝΣΗ ΜΕ β-NODAVIRUS ΚΑΙ Η ΣΗΜΑΣΙΑ ΤΟΥΣ ΓΙΑ ΤΗΝ ΔΗΜΟΣΙΑ ΥΓΕΙΑ»
2010-2013, EPAN II-SP-09SYN-24-323, Ευρωπαϊκή Ένωση και Υπουργείο Ανάπτυξης
«ΕΝΑΛΛΑΚΤΙΚΕΣ ΠΡΟΣΤΑΤΕΥΤΙΚΕΣ ΜΕΘΟΔΟΙ ΚΑΙ ΘΕΡΑΠΕΙΕΣ ΣΤΙΣ ΕΛΛΗΝΙΚΕΣ ΙΧΘΥΟΚΑΛΛΙΕΡΓΕΙΕΣ»
2011-2014, EPAN II-SP-09SYN-14-643, Ευρωπαϊκή Ένωση και Υπουργείο Ανάπτυξης
«ΣΥΝΘΕΣΗ ΠΟΛΥΜΕΡΙΚΏΝ ΝΑΝΟΣΩΜΑΤΙΔΙΩΝ ΓΙΑ ΤΗΝ ΣΤΟΧΕΥΣΗ ΤΟΥ ΑΝΤΙΓΟΝΟΥ ΣΕ ΔΕΝΔΡΙΤΙΚΑ»
2009-2010, Institute Pasteur International Network (RIIP- ACIP)
«VALIDATION OF LeIF AND OTHER DEAD BOX PROTEIN AS NATURAL ADJUVANTS»
2008-2009, ENTARCO S.A. ΙΔΙΩΤΙΚΟ ΕΜΠΙΣΤΕΥΤΙΚΟ ΣΥΜΦΩΝΗΤΙΚΟ
«In vitro ΔΙΕΡΕΥΝΗΣΗ ΝΕΩΝ ΣΥΝΘΕΤΙΚΩΝ ΟΥΣΙΩΝ ΜΕ ΑΝΤΙΛΕΙΣΜΑΝΙΑΚΗ ΔΡΑΣΗ»
2000-2002, Ειδικός Λογαριασμός, Ε.Ι.Π. «ΔΙΑΛΟΓΟΣ ΜΕΤΑΞΥ ΔΕΝΔΡΙΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΚΑΙ CD8+ T ΛΕΜΦΟΚΥΤΤΑΡΑ ΣΕ ΠΕΙΡΑΜΑΤΙΚΟ ΜΟΝΤΕΛΟ ΛΕΪΣΜΑΝΙΑΣΕΩΝ»
1999-2001, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας. Πρόγραμμα ενίσχυσης ερευνητικού δυναμικού (ΠΕΝΕΔ 1999, Κ.Α.5065) «ΑΝΑΠΤΥΞΗ ΑΝΟΣΟΠΑΡΕΜΒΑΤΙΚΩΝ ΤΕΧΝΙΚΩΝ ΣΤΗΝ ΑΠΟΚΡΙΣΗ ΚΑΤΑ ΕΝΔΟΚΥΤΤΑΡΙΚΩΝ ΑΝΤΙΓΟΝΩΝ ΜΕ ΤΗΝ ΧΡΗΣΗ ΣΥΜΠΛΗΡΩΜΑΤΙΚΩΝ ΚΑΙ ΔΙΑΜΟΡΦΩΤΙΚΩΝ ΠΕΠΤΙΔΙΩΝ ΣΕ ΠΕΙΡΑΜΑΤΙΚΑ ΜΟΝΤΕΛΑ ΚΑΙ ΑΝΘΡΩΠΟΥΣ»
1998-2000, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας. Πρόγραμμα Ανάπτυξης Βιομηχανικής Έρευνας (ΠΑΒΕ 97ΠΑΒΕ230)
«ΔΙΑΤΡΟΦΙΚΟΙ ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΕΠΗΡΕΑΖΟΥΝ ΤΗΝ ΑΝΑΠΤΥΞΗ, ΕΚΜΕΤΑΛΕΥΣΗ ΤΗΣ ΤΡΟΦΗΣ, ΥΓΕΙΑ ΚΑΙ ΑΝΤΟΧΗ ΣΕ ΑΣΘΕΝΕΙΕΣ ΤΟΥ ΕΙΔΟΥΣ PUNTAZZO PUNTAZZO ΣΕ ΣΥΝΘΗΚΕΣ ΕΝΤΑΤΙΚΗΣ ΕΚΤΡΟΦΗΣ»
1998-2000, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας. Πρόγραμμα Ανάπτυξης Βιομηχανικής Έρευνας (ΠΑΒΕ 97ΠΑΒΕ103)
«ΜΕΛΕΤΗ ΤΗΣ ΠΑΘΟΛΟΓΙΑΣ ΜΕΤΑΔΟΣΗΣ ΚΑΙ ΚΑΤΑΠΟΛΕΜΗΣΗΣ ΤΗΣ ΜΥΞΟΣΠΟΡΙΔΙΑΣΗΣ ΣΕ ΕΝΤΑΤΙΚΕΣ ΚΑΛΛΙΕΡΓΕΙΕΣ ΤΩΝ ΘΑΛΑΣΣΙΩΝ ΨΑΡΙΩΝ Sparus aurata KAI Puntazzo puntazzo»
1995-1998, Minister of Industry, Energy and Technology, EC support Framework II, Operational Program for Research and Development (EPET II)
«FORMULATION AND MANUFACTURE OF FISH FEEDS CHARACTERIZED BY HIGH NUTRITIONAL VALUE AND LOW ENVIRONMENTAL IMPACT»
1994-1996, EC, Human Capital and Mobility. «THE DEVELOPMENT OF PCR ASSAY FOR THE DETECTION OF CRYPTIC LEISHMANIΑSES AND ITS APPLICATION TO THE STUDY OF THE DISEASE IN GREECE AND THROUGHOUT EUROPE»
1993-1996, EC, Biotechnology.
«AN INVESTIGATION INTO THE MECHANISMS OF ADJUVENTICITY OF IMMUNOSTIMULATING COMPLEXES (ISCOMS) OF DEFINED CHEMICAL COMPOSITION USING A PRIMATE MODEL OF EBV VIRUS INDUCED LYMPHOMA»
1989-1992, Ειδικός Λογαριασμός Ε.Ι.Π. ΑΝΟΣΟΛΟΓΙΑ ΛΕΙΣΜΑΝΙΑΣΕΩΝ
ΧΡΗΜΑΤΟΔΟΤΗΣΕΙΣ ΠΡΟΓΡΑΜΜΑΤΩΝ ΟΡΙΖΟΝΤΙΩΝ ΔΡΑΣΕΩΝ
2005, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας, Εβδομάδα Επιστήμης και Τεχνολογίας
«ΤΟ ΕΛΛΗΝΙΚΟ ΙΝΣΤΙΤΟΥΤΟ ΠΑΣΤΕΡ ΚΑΙ Ο 21ος ΑΙΩΝΑΣ ΣΤΙΣ ΒΙΟΙΑΤΡΙΚΕΣ ΕΠΙΣΤΗΜΕΣ»
2006-2008, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας, Ανοιχτές Θύρες – 2ος Κύκλος
«ΒΙΟΙΑΤΡΙΚΗ ΕΡΕΥΝΑ ΚΑΙ ΑΡΙΣΤΕΙΑ: ΠΡΟΒΟΛΗ ΤΩΝ ΕΠΙΣΤΗΜΟΝΙΚΩΝ ΕΠΙΤΕΥΓΜΑΤΩΝ ΤΟΥ ΕΛΛΗΝΙΚΟΥ ΙΝΣΤΙΤΟΥΤΟΥ ΠΑΣΤΕΡ»
2006. Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας. Εβδομάδα Επιστήμης και Τεχνολογίας
«ΟΤΑΝ Η ΕΠΙΣΤΗΜΗ ΓΙΝΕΤΑΙ ΕΝΑ ΣΥΝΑΡΠΑΣΤΙΚΟ ΤΑΞΙΔΙ ΓΝΩΣΕΩΝ»
2004-2007, Υπουργείο Ανάπτυξης – Γενική Γραμματεία Έρευνας και Τεχνολογίας (Κωδικός 03ΓΔΜ1)
«ΓΡΑΦΕΙΟ ΔΙΑΜΕΣΟΛΑΒΗΣΗΣ ΕΛΛΗΝΙΚΟ ΙΝΣΤΙΤΟΥΤΟ ΠΑΣΤΕΡ
Όλγα Κουτσώνη, Βιολόγος (Υποτροφία εκπόνησης PhD 2005-2009)
Πρόσφατη διεύθυνση: Εργαστήριο Κυτταρικής Ανοσολογίας, Τμήμα Μικροβιολογίας, Ελληνικό Ινστιτούτο Παστέρ, Αθήνα, Ελλάδα
Ιωάννης Κυριαζής, Βιολόγος (Υποτροφία εκπόνησης PhD 2005-2009, υποτροφία εκπόνησης μετα-διδακτορικής έρευνας 2009-2015)
Πρόσφατη διεύθυνση: Center for Translational Medicine and the Center for Metabolic Diseases Research Temple University School of Medicine, Philadelphia, USA
Παναγιώτης Τσαγκόζης, Βιολόγος-MD (Εκπόνηση PhD 2004-2010)
Πρόσφατη διεύθυνση: The Royal Orthopaedic Hospital, Bristol Road South, Birmingham, B31 2AP, UK; Section of Orthopaedics, Department of Molecular Medicine and Surgery, Karolinska University Hospital, Solna, 17176, Stockholm, Sweden
Μαρία Παπαματθέου, Βιολόγος, (Εκπόνηση PhD 2000-2007)
Πρόσφατη διεύθυνση: Βιολόγος Δευτεροβάθμιας Εκπαίδευσης
Ευδοκία Καραγκούνη, Βιολόγος, PhD (Yποτροφία εκπόνησης μετα-διδακτορικής έρευνας 1989-1994)
Πρόσφατη διεύθυνση: Προϊσταμένη Τμήματος Μικροβιολογίας, Υπεύθυνη Ομάδας Ανοσολογίας Παρασιτώσεων, Ελληνικό Ινστιτούτο Παστέρ, Αθήνα, Ελλάδα
Μεταπτυχιακοί Φοιτητές (Εκπόνηση MSc):
1. Καλλιόπη Καραμπέτσου (2014-2016)
2. Παναγιώτης Χατζόβουλος (2007-2009)
3. Ειρήνη Κωνσταντά (2008-2010)
Koutsoni OS, Karampetsou K., Kyriazis I.D., Stathopoulos P, Aligiannis N., Halabalaki M, Leandros A., Skaltsounis L.A., Dotsika E. 2018. Evaluation of total phenolic fraction derived from extra virgin olive oil for its antileishmanial activity. Phytomedicine (in press).
Papastamatiou T, Routsias JG, Koutsoni O, Dotsika E, Tsakris A, Spoulou V., “Evaluation of Protective Efficacy of Selected Immunodominant B-Cell Epitopes within Virulent Surface Proteins of Streptococcus pneumoniae”, Infect Immun. 2018 Feb 20;86(3). pii: e00673-17. doi: 10.1128/IAI.00673-17.
2018
Koutsoni OS, Routsias JG, Kyriazis ID, Barhoumi M, Guizani I, Tsakris A, Dotsika E. 2017. In silico analysis and in vitro evaluation of immunogenic and immunomodulatory properties of promiscuous peptides derived from Leishmania infantum eukaryotic initiation factor. Bioorg Med Chem. Nov 1;25(21):5904-5916.
Boutsini S, Athanasiou LV, Spanakos G, Ntousi D, Dotsika E, Bisia M, Papadopoulos E. 2017. Phlebotomine sandflies and factors associated with their abundance in the leishmaniasis endemic area of Attiki, Greece. Parasitol Res. Nov 10. doi: 10.1007/s00436-017-5675-8
D. Kyriazis, D. Smirlis, A. Papadaki, O. Koutsoni, N. Aligiannis, A. L. Skaltsounis, E. Dotsika. 2017. Leishmanicidal activity of oleuropein: L. donovani promastigote cell death through a possibly ROS-independent mechanism. Journal of Pharmacognosy & Natural Products 3(1):2-7 doi: 10.4172/2472-0992.1000141.
2017
Kyriazis I.D., O.S. Koutsoni, N. Aligiannis, K. Karampetsou, A.L. Skaltsounis, E. Dotsika (2016). “The leishmanicidal activity of oleuropein is selectively regulated through inflammation and oxidative stress-related genes.” Parasit Vectors. Aug9;9(1):441. doi: 10.1186/s13071-016-1701-4.
2016
Tseveleki V., T. Tselios, I. Kanistras, O.S. Koutsoni, M. Karamita, S.S. Vamvakas, V. Apostolopoulos, E. Dotsika, J. Matsoukas, H. Lassmann, and L. Probert (2015). “Mannan-conjugated myelin peptides prime non-pathogenic Th1 and Th17 cells and ameliorate experimental autoimmune encephalomyelitis.” Experimental Neurology 267: 254-267.
2015
Agallou M, E. Athanasiou , O.S. Koutsoni, E. Dotsika, E. Karagouni (2014). “Experimental Validation of Multi- Epitope Peptides Including Promising MHC Class I- and II-Restricted Epitopes of Four Known Leishmania infantum Proteins.” Front Immunol. 10;5:268. doi: 10.3389/fimmu.2014.00268.
Agallou M., E. Dotsika, E. Karagouni (2014). “Low CD40 expression levels in Leishmania infantum-infected bone marrow dendritic cells evokes regulatory responses by down-regulating IL-12 production: Role of ERK1/2.” Eur. J. Inflammation. 12(2): 315-328.
Koutsoni O.S., M. Barhoumi, I. Guizani, E. Dotsika (2014). “Leishmania Eukaryotic Initiation Factor (LeIF) Inhibits Parasite Growth in Murine Macrophages.”PLoS One.15;9(5):e97319doi:10.1371/journal.pone. 0097319.
Agallou M., E. Dotsika, S. Frydas, Karagouni E. (2014). “Toll-like receptor 4 promotes control of Leishmania infantum infection through inducement of leishmanicidal activity in host macrophages: role of mitogen activated kinases.” J Biol Regul Homeost Agents. 28(1):41-52.
2014
Papagiannopoulos IA, V.I. Sideris, M. Boschmann., O.S. Koutsoni, E. Dotsika (2013). “Anthropometric, hemodynamic, metabolic, and renal responses during 5 days of food and water deprivation.” Forsch Komplementmed. 20(6):427-33. doi: 10.1159/ 000357718.
Rigos G, E. Fountoulaki, E. Cottou, E. Dotsika, N. Dourala, I. Karacostas (2013). “Tissue distribution and field evaluation of caprylic acid against natural infections of Sparicotyle chrysophrii in cage-reared gilthead sea bream Sparus aurata.” Aquaculture 408-409:15-19.
2013
Kyriazis JD, N. Aligiannis, P. Polychronopoulos, A.L. Skaltsounis, E. Dotsika. (2012). “Leishmanicidal activity assessment of olive tree extracts.” Phytomedicine. 20(3-4):275-81.
2012
Koutsoni O., M. Barhoumi, I. Guizani and E. Dotsika. (2011). “LiEIF and its recombinant polypeptides enhance the maturation of mouse dendritic cells and the production of the protective IL-12 cytokine.” BMC proceedings 01/2011; 5:1-1. 5:1-1. DOI:10.1186/1753-6561-5-S1.
Barhoumi M., Koutsoni O., Guizani I., Dotsika E., “Characterization of immunomodulatory activity of eIF4A protein” BMC Proceedings 2011, 5 (Suppl 1):O.
2011
Tsatchev I., I.D. Kyriazis, S. Boutsini, E. Karagouni and E.Ν. Dotsika. (2010).” First Report of canine visceral leishmaniasis in Bulgaria.” Turkish J. Vet. Anim. Science 34(3):1-5.
Chatzovoulos P.S., A.B. Tsoupras, M. Samiotaki, G. Panayotou, C.A. Demopoulos, E.Ν. Dotsika (2010). “PAF-mediated enzymes and PAF-like molecules in L. infantum and L. major promastigotes.” European. Journal of Inflammation 9(3), 231-239.
2010
Kyriazis I.D., E. Karagouni, K. Soteriadou, A.L. Skaltsounis, E. Dotsika. (2008). “Olive tree extracts with potential leishmanicidal activity.” Planta Med 74 – PA 83, DOI; 10.1055/s-0028-1084081
2008
Tseveleki V., P. Tsagozis, O.S. Koutsoni, E. Dotsika, L. Probert (2007). “Cellular FLIP long isoform transgenic mice overcome inherent Th2-biased immune responses to efficiently resolve Leishmania major infection.” Int. Immunol 19(10): 1183-1189.
2007
Karagouni E., F. Athanasopoulou, A. Lytra, C. Komis, E.Ν. Dotsika. (2005). “Antiparasitic and immunomodulatory effect of innovative treatments against Myxobulus sp infection in Diplodus puntazzo.” Veterinary Parasitology. 134(3-4): 215-228.
Τsagozis P., E.E. Karagouni, E.N. Dotsika. (2005). “Function of CD8+ T lymphocytes in a self-curing mouse model of Visceral leishmaniasis.” Parasitology International 54:139-146.
2005
Karagouni E.E., F. Athanasopoulou, P. Tsagozis, E. Ralli, Th. Moustakareas, K. Lytra and E. Dotsika. (2004).“The impact of a successful anti-myxosporean treatment on the phagocytic functions of juvenile and adult Sparus aurata”. L. Intern. J. Immunol. Pharmac. 18(1): 121-1.
Τsagozis P., V. Tseveleki, , E.N. Dotsika, E.E. Karagouni. (2004). “Vaccination with plasmids encoding the Leishmania major gp63 glycoprotein and CD40L results in a partial suppression of the inflammatory reaction after experimental infection.” Eur. J. Inflamm. 2(2): 91-96.
Athanasopoulou F., E.E Karagouni. E.Ν. Dotsika, V Ragias, J. Tavla, P Christofilloyanis and I.Vatsos. (2004). “Efficacy and toxicity of orally administrated anti-coccidial drugs for innovative treatments of Myxobulus sp. Infection in sharpsnoot seabream Puntazzo puntazzo C.”, Deseases of Aquatic Organisms. 62:217-226.
Athanasopoulou F., E.E Karagouni. E.Ν. Dotsika, V Ragias, J. Tavla, and P Christofilloyanis. (2004). “Efficacy and toxicity of orally administrated anti-coccidial drugs for innovative treatments of Polysporoplasma sparis infection in Sparus aurata L.” Journal of applied Ichthyology. 20: 345-354
Τsagozis P., E.E. Karagouni, E.N. Dotsika. (2004). “Dedritic cells pulsed with peptides of gp63 induced differential protection against experimental cutaneous leishmaniasis.” Internat. J. Immunopathol. Pharmac. 17(3): 343-352.
Papamattheou M., J. Routsias, E.E.Karagouni, C. Sakarellos, M. Sakarellos-Daitsotis, H.M. Moutsopoulos, A.G. Tzioufas, E.N. Dotsika. (2004). “T cell help is required to induce idiotypic-antiidiotypic autoantibody network after immunization with complementary epitope 289-308aa of La/SSB autoantigen in non-autoimmune mice.” Clin. Exp. Imm., 135: 416-426.
2004
Τsagozis P., E.E. Karagouni, E.N. Dotsika. (2003). “CD8+ T cells with parasite spesific cytotoxic activity and a Tc1 profile of cytokine secretion develop in experimental visceral leishmaniasis.” Parasite Immunol., 23: 569- 579.
Routsias G. J., E.N. Dotsika, Touloupi E., M. Papamattheou, C. Sakarellos, M. Sakarellos-Daitsiotis, H.M. Moutsopoulos, A.G. Tzioufas. (2003). “Idiotypic-antiidiotype circuit in non-autoimmune mice after immunization with the epitope and complementary epitope 289-308aa of La/SSB response.” J. Autoimmun., 21 : 17-26.
2003
Routsias G. J., E. Touloupi, E.N. Dotsika, V. Tsikaris, C. Sakarellos, M. Sakarellos-Daitsiotis, H.M. Moutsopoulos, A.G. Tzioufas. (2002). “Unmasking the ant-La/SSB response by specific blocking of ant-idiotypic antibodies with sense-complementary peptides to La/SSB major antigenic determinants.” Mol. Med., 8 : 293-305.
2002
Hemmerlin C., A. Phan Chan Du, Z. Elhilali, A. Moulia, V. Tsikaris, M. Sakarellos-Daitsiotis, C. Sakarellos, E.N. Dotsika, A.G. Tzioufas, H.M. Moutsopoulos, Manh-Thong Cung. (2001). “Conformational study of the complementary peptide to a B-cell epitope of the La/SSB autoantigen.” Chimie/Chemistry, 4 : 729-733.
2001
Sideris, V., G. Papadopoulou, E.N. Dotsika and E. Karagouni. (1998). “Asymptomatic canine leishmaniasis in the greater Athens area, Greece.” Eur. J. Epidemiol., 15 : 271-276.
Frydas S., M. Reale, R.C. Barbacane, F.C. Placido, E.E. Karagouni, E.N. Dotsika, M. Trakatellis, D. Vacalis, A. Trakatellis, and P. Conti. (1998). “IgG, IgG1 and IgM response in Trichinella spiralis infected mice treated with 4-deoxypyridoxine or fed a vitamine B6 deficient diet.” Molec. Cellul. Biochem., 194(1-2) : 47-52.
Karagouni E.E., A. Chrysicopoulos, Th. Matzavinos, N. Kanakas and E.N. Dotsika. (1998). “Interleukin-1b and interleukin-1a may affect the implantation rate of patients undergoing in vitro fertilization–embryo transfer.” Fertil. Steril., 70 : 553-559.
Doukas V., F. Athanasopoulou, E. Karagouni and E.N Dotsika. (1998). “A case of Aeromonas hydrophyla infection in cultured sea bass (Dicentrarnchus labrax) and Puntazzo puntazzo from the Agean sea.” J. Fish Dis., 21 : 101-104.
Papadopoulou G., E. Karagouni and E.N. Dotsika. (1998). “An iscoms vaccine against experimental leishmaniasis.” Vaccine, 16(9/10) : 885-892.
1998
Dotsika, E.N., E.E. Karagouni, B. Sundquist, B. Morein A.J. Morgan, and M. Villacres-Eriksson. (1997). “Influence of Quillaja saponaria triterpenoid content on the mmunomodulatory capacity of Epstein-Barr virus(EBV) iscoms.” Scand. J. Immunol., 45 : 261-268.
1997
Chryssikopoulos A., Th Mantzavinos, N. Kanakas, E.E. Karagouni, E.N. Dotsika, and P.A. Zourlas. (1996). “Correlation of serum and follicular fluid concentrations of placenta protein 14 and CA-125 in in vitro fertilization-embryo transfer patients.” Fertil. Steril., 66(4) : 599-603.
Sideris, V., E.E. Karagouni, G. Papadopoulou, A. Garyfallou and E.N. Dotsika. (1996). “Canine visceral leishmaniasis in the greater Athens area, Greece.” Parasite, 3 : 125-130.
Frydas, S., E.E. Karagouni, E.N. Dotsika, M. Reale, R.C. Barbacane, I. Vlemmas, G. Anogianakis, A. Trakatellis, and P. Conti. (1996). “Generation of TNFá, IFN-γ, IL-6, IL-4 and IL-10 in mouse serum from trichinellosis. Effect of the anti-inflammatory compound 4-deoxypyridoxine (4-DPD).” Immunol. Let., 49 : 179- 184.
1996
Haralabidis, S., E.E. Karagouni, S. Frydas, and E.N. Dotsika. (1995). “Immunoglobulin and cytokine profile in murine secondary hydatidosis.” Parasite Immunol., 17 : 625-530.
Karagouni, E.E., S. Frydas, E.N. Dotsika, C. Himonas, P.Conti and A. Trakatellis. 1995. “Inhibition of TNF-α and IL-6, but not IFN-γ, by 4-deoxypyridoxine (4-DPD) in Trichinella-infected mouse serum.” Int. J. Immunopath. Pharmacol., 8(1) : 9-14.
1995
Frydas, S., A. Trakatellis, E.E. Karagouni, E.N. Dotsika, C. Himonas and P. Conti. (1994). deoxypyridoxine inhibits chronic granuloma formation induced by potassium permanganate in vivo.” Molec. Cellul. Biochem., 136 : 59-63.
Karagouni, E.E., E.N. Dotsika and A. Sklavounou. (1994). “Alteration in peripheral blood mononuclear cell function and serum cytokines in oral lichen planus.” J. Oral Pathol. Med., 23 : 28-35.
1994
Dotsika E.N. “Assays for mediators affecting cellular immune functions.” (1990). Cur. Opin. Immunol., 2 : 932-935.
1990
Dotsika E.N. and C.J. Sanderson. (1987).“Interleukin 3 production as a sensitive measure of T lymphocyte activation in the mouse.” Immunol., 62 : 665-668.
Dotsika E.N. and C.J. Sanderson. (1987). “A fluorometric assay for determining cell growth in lymphocyte proliferation and lymphokine assays.” J. Immunol. Meth., 105 : 55-62.
1987
Dotsika E.N. (1984). “Studies on immunological tolerance in mice.” PhD Thesis. The Medical School, University of Bristol, Bristol, UK
1984
